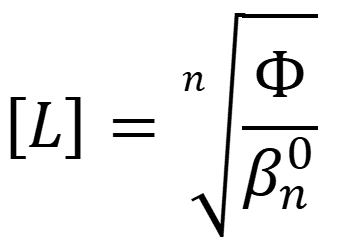Процессы комплексообразования
В общем виде комплексообразование в растворе описывается суммарным уравнением:
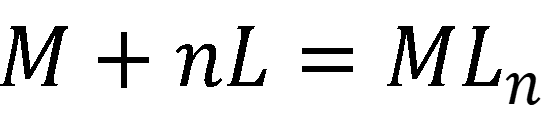
Константа равновесия называется константой устойчивости:
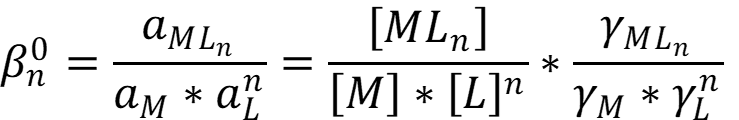
Суммарная константа устойчивости является произведением ступенчатых констант для каждой ступени образования:

Величина обратная константе устойчивости называется константа нестойкости:
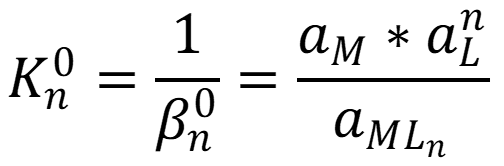
Функция образования (среднее координационное число) – соотношение концентрации лиганда, c вязанного в комплекс, к общей концентрации иона металла-комплексообразователя:
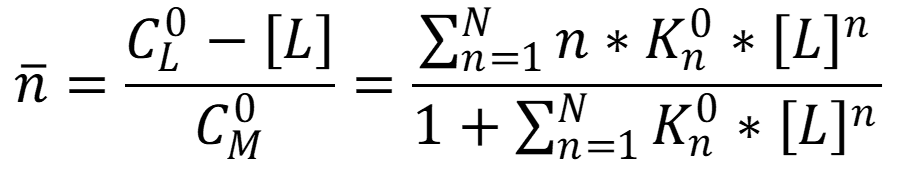
Для описания состава раствора используют:
- Мольная доля:
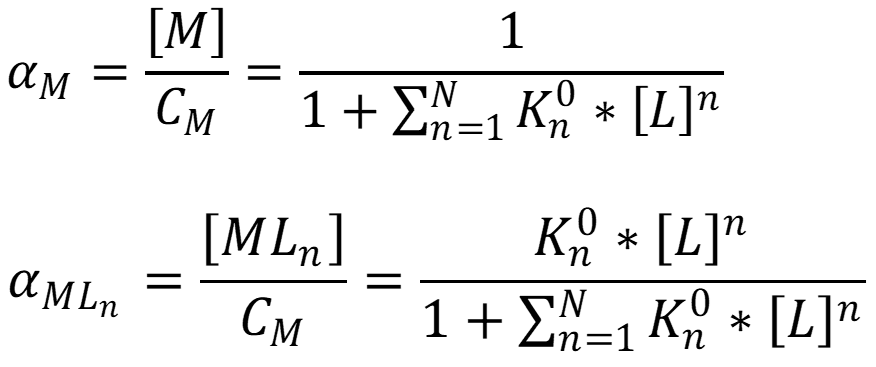
- Закомплексованность:
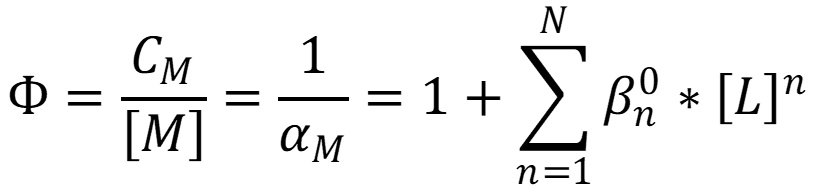
При избытке лиганда в растворе:
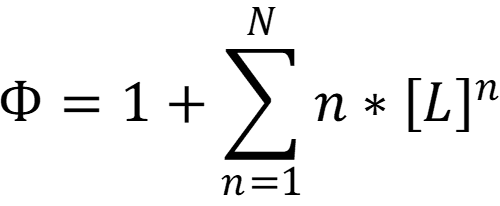
При использовании логарифмов констант удобней использовать формулу:
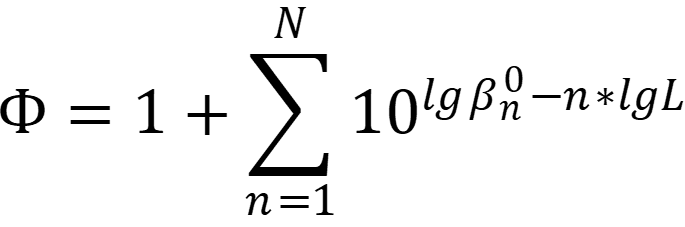
При допущении об одноступенчатом механизме реакции концентрацию лиганда, обеспечивающую необходимую степень маскирования, можно вычислить по формуле: